鐳
 | ||||||||||||||||||||||||||||||||||||
| 鐳 | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 發音 | (Ray-Dee-əm) | |||||||||||||||||||||||||||||||||||
| 外貌 | 銀白金金屬 | |||||||||||||||||||||||||||||||||||
| 質量數 | [226] | |||||||||||||||||||||||||||||||||||
| 週期表中的鐳 | ||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||
| 原子數( z ) | 88 | |||||||||||||||||||||||||||||||||||
| 團體 | 第2組(鹼土金屬) | |||||||||||||||||||||||||||||||||||
| 時期 | 時期7 | |||||||||||||||||||||||||||||||||||
| 堵塞 | S塊 | |||||||||||||||||||||||||||||||||||
| 電子配置 | [ RN ] 7s 2 | |||||||||||||||||||||||||||||||||||
| 每個外殼的電子 | 2, 8, 18, 32, 18, 8, 2 | |||||||||||||||||||||||||||||||||||
| 物理特性 | ||||||||||||||||||||||||||||||||||||
| 階段在STP | 堅硬的 | |||||||||||||||||||||||||||||||||||
| 熔點 | 973 K (700°C,1292°F) (有爭議) | |||||||||||||||||||||||||||||||||||
| 沸點 | 2010 K(1737°C,3159°F) | |||||||||||||||||||||||||||||||||||
| 密度(接近RT ) | 5.5 g/cm 3 | |||||||||||||||||||||||||||||||||||
| 融合熱 | 8.5 kJ/mol | |||||||||||||||||||||||||||||||||||
| 汽化熱 | 113 kJ/mol | |||||||||||||||||||||||||||||||||||
蒸汽壓力
| ||||||||||||||||||||||||||||||||||||
| 原子特性 | ||||||||||||||||||||||||||||||||||||
| 氧化狀態 | +2 (預計具有強鹼性氧化物) | |||||||||||||||||||||||||||||||||||
| 電負性 | 鮑林量表:0.9 | |||||||||||||||||||||||||||||||||||
| 電離能 |
| |||||||||||||||||||||||||||||||||||
| 共價半徑 | 221±2 pm | |||||||||||||||||||||||||||||||||||
| 范德華半徑 | 283 pm | |||||||||||||||||||||||||||||||||||
| 其他屬性 | ||||||||||||||||||||||||||||||||||||
| 自然發生 | 從腐爛 | |||||||||||||||||||||||||||||||||||
| 晶體結構 | 以身體為中心(BCC) | |||||||||||||||||||||||||||||||||||
| 導熱係數 | 18.6 W/(M·K) | |||||||||||||||||||||||||||||||||||
| 電阻率 | 1 µΩ·m(在20°C下) | |||||||||||||||||||||||||||||||||||
| 磁性排序 | 非磁性 | |||||||||||||||||||||||||||||||||||
| CAS號 | 7440-14-4 | |||||||||||||||||||||||||||||||||||
| 歷史 | ||||||||||||||||||||||||||||||||||||
| 發現 | 皮埃爾和瑪麗·居里(1898) | |||||||||||||||||||||||||||||||||||
| 第一個隔離 | 瑪麗·庫裡(Marie Curie )(1910) | |||||||||||||||||||||||||||||||||||
| 鐳的同位素 | ||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||
鐳是化學元素。它具有符號RA和原子數88。它是元素週期表2組的第六個元素,也稱為鹼土金屬。純輻射是銀白色,但在暴露於空氣時很容易與氮(而不是氧)反應,形成了氮化ride的黑色表面層(RA 3 N 2 )。所有的同位素是放射性的,最穩定的同位素是鐳226 ,半衰期為1,600年。當輻射衰減時,它將電離輻射作為副產品發出,可以激發熒光化學物質並引起放射性發光。
1898年,瑪麗(Marie )和皮埃爾·庫裡(Pierre Curie)從賈奇摩夫( Jáchymov )開采的礦石(礦石)發現了陽台,以氯化鐳的形式發現。他們從鈾素中提取了鐳化合物,並在五天后在法國科學院發表了這一發現。瑪麗·庫裡(Marie Curie)和安德烈·路易斯·德比爾(André-Louis Debierne)通過1911年的氯化賴賴洛克斯(André-Louis Debierne)在其金屬狀態下分離了鐳。
在自然界中,在鈾礦石中發現了鐳,並且(在較小程度上) thor礦的痕量小至每噸鈾礦的第七克。陽台對於活生物體不是必需的,其放射性和化學反應性會導致不良的健康影響,因為其化學模仿鈣,因此將其納入生化過程。截至2014年,除了在核醫學中使用外,鐳還沒有商業應用。以前,在1950年代左右,它被用作放射性發光設備的放射性來源,也被用作放射性震動的質量。由於鐳的毒性,這些應用已經過時了。截至2020年,(其他元素的)危險同位素較小,而是用於放射性發光設備中。
散裝特性
鐳是最重的已知鹼土金屬,是其組唯一的放射性成員。它的物理和化學特性最類似於其較輕的同源物鋇。
純鐳是一種揮發性的銀白色金屬,儘管其較輕的同源物鈣,鍶和鋇具有略微黃色的色調。這種色彩在暴露於空氣的情況下迅速消失,產生了可能是氮化鐳的黑色層(RA 3 N 2 )。它的熔點為700°C(1,292°F)或960°C(1,760°F),其沸點為1,737°C(3,159°F);但是,這並不是很好。這兩個值略低於鋇的值,確認了第2組元素的週期性趨勢。像鋇和鹼金屬一樣,在標準溫度和壓力下以體內的立方結構結晶的鐳:輻射 - 亞輻射鍵的距離為514.8皮儀。鐳的密度為5.5 g/cm 3 ,高於鋇的密度,再次證實了周期性的趨勢。由於兩個元素的相似晶體結構,陽離子銨密度比與陽離子 - 銨原子質量比相當。
同位素
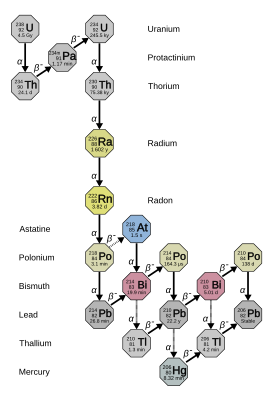
鐳有33個已知的同位素,質量為202至234:它們都是放射性的。其中有四個 - 223 RA (半衰期11.4天), 224 RA(3.64天), 226 RA(1600年)和228 RA(5.75年) - 自然發生在原始Thorium-232的衰減鏈中,鈾 - 235和鈾238 (來自鈾235的223 RA,鈾238的226 RA,另外兩個來自Thorium-232)。然而,這些同位素仍然具有半衰期太短,無法成為原始放射性核素,並且僅在自然界中存在這些衰變鏈中。與大多數人工225 RA(15 d)一起,它在自然界中僅作為Neptunium-237的微小痕蹟的衰減產物出現,這是輻射的五個最穩定的同位素。所有其他27個已知的鐳同位素的半衰期在兩個小時以下,大多數人的半衰期不到一分鐘。已經報告了至少12個核異構體;它們中最穩定的是輻射205m,半衰期在130〜230毫秒之間。這仍然比二十四個地下陽離子同位素短。
在放射性研究的早期歷史中,給出了不同的鐳的不同自然同位素。在此方案中, 223 RA被命名為Actinium X(ACX), 224 Ra Thor X(Thx), 226 Ra radium(RA)和228 RA中胸1(MSTH 1 )。當人們意識到所有這些都是同一元素的同位素時,其中許多名稱不使用,而“ radium”開始指代所有同位素,而不僅僅是226 ra。 Radium-226的一些衰減產品中的一些收到了歷史名稱,包括“鐳”,範圍從鐳A到radium g ,字母大約表明它們距離鏈條距離鏈條距離距離距離距離很高,而radium imanation = 222 rn, ra a = 222 rn = 218 PO, RA B = 214 Pb, RA C = 214 BI, RA C 1 = 214 PO, RA C 2 = 210 TL, RA D = 210 Pb,RA E = 210 BI, RA F = 210 PO和RA G = 206 pb。
226 RA是鐳最穩定的同位素,是鈾238的(4 n + 2)衰減鏈中的最後一個同位素,半衰期超過一千年:它幾乎構成了所有天然鐳。它的直接衰減產物是緻密的放射性貴重氣體ra (特別是同位素222 RN ),它是環境賴以生存的許多危險。由於其半衰期較短,它的放射性比同一摩爾量的天然鈾高270萬倍(主要是鈾238)。
由於發射的輻射,輻射金屬樣品的溫度低於周圍的溫度 - α顆粒, β顆粒和伽馬射線。更具體地說,天然鐳(主要是226 RA)發出的主要是α顆粒,但其衰減鏈中的其他步驟(鈾或鐳序列)會發出alpha或beta顆粒,幾乎所有粒子排放都伴隨著γ射線。
2013年,在CERN發現,radium-224的核是使用一種稱為庫侖激發的技術。這是不對稱核的第一個發現。這是一個有力的間接證據,表明某些沉重的,不穩定的原子核在這種情況下扭曲了核,在這種情況下是梨的形狀。
化學
鐳與鋇一樣,是一種高反應性的金屬,始終表現出其+2的基團氧化態。它在水溶液中形成無色RA 2+陽離子,該水溶液高度鹼性並且不容易形成複合物。因此,大多數輻射化合物都是簡單的離子化合物,儘管由於相對論效應,預期6s和6p電子(除了價7s電子之外)的參與預計會增強仙境化合物的共價特徵,例如RA F 2和RA,在2 。因此,半反應Ra 2+ (aq) + 2e- →ra(s)的標準電極電勢為-2.916 V ,甚至略低於鋇的值-2.92 V增加了組(CA:-2.84 V; SR:- 2.89 V; BA:-2.92 V)。鋇和鐳的值幾乎與較重的鹼金屬鉀, rubium和cesium的值完全相同。
化合物
固體輻射化合物是白色的,因為鐳離子沒有特定的顏色,但是由於輻射的α衰變的自放射分解,它們會逐漸變黃,然後隨著時間的推移變暗。不溶性鐳化合物與所有鋇,大多數和大多數鉛化合物共沉澱。
儘管氧化物是另一種鹼性地球金屬的常見化合物,但氧化物(RAO)的表徵尚未超過其存在。氫氧化賴(RA(OH) 2 )是鹼氫氧化物中最容易溶於的,它的鹼基比其鋇同同類液氫氧化鋇更強。它也比氫氧化陽離子和氫氧化元更易溶:這三個相鄰的氫氧化物可以通過用氨水沉澱它們來分離。
氯化鐳(RACL 2 )是一種無色的發光化合物。一段時間後,由於輻射腐爛時散發出的α輻射自我破壞而變成黃色。少量的鋇雜質使該化合物具有玫瑰色。它可溶於水,儘管少於氯化鋇,其溶解度隨著鹽酸濃度的增加而降低。從水溶液中結晶的二氫含量RACL 2 ·2H 2 O,與鋇類似物的異陣形。
溴化鐳(RABR 2 )也是一種無色的發光化合物。在水中,它比氯化鐳更可溶。與氯化賴賴賴斯一樣,從水溶液中結晶得出的二氫酸Rabr 2 ·2H 2 O,以及其鋇類似物的同構。溴化陽極發射的電離輻射激發了空氣中的氮分子,使其發光。輻射發出的α顆粒迅速獲得兩個電子,形成中性氦氣,這會累積在內部並削弱溴化物晶體。這種效果有時會導致晶體破裂甚至爆炸。
硝酸鹽(RA(NO 3 ) 2 )是一種白色化合物,可以通過將碳酸鹽溶解在硝酸中製成。隨著硝酸濃度的增加,硝酸賴賴賴調賴賴斯的溶解度降低,這是賴賴化學純化的重要特性。
鐳的形成與較輕的液鋇相同的不溶性鹽:它形成不溶性硫酸鹽(RASO 4 ,最不溶性已知的硫酸鹽),鉻酸鹽(Racro 4 ),碳酸鹽(Raco 3 )(Raco 3 ),碘化物(RA(RA(IO 3 )2) 2 ) ,Tetrafluoroberyllate(Rabef 4 )和硝酸鹽(RA(NO 3 ) 2 )。除碳酸鹽外,所有這些都比相應的鋇鹽少於水,但它們都是鋇對應物的同一結構。另外,磷酸鐳,草酸鹽和亞硫酸鹽可能與相應的不溶性鋇鹽共沉澱時,也可能不溶。硫酸賴賴賴斯賴斯賴以生物賴以生物學上較小的鐳化合物之一。 RA 2+ (148 pm)的大離子半徑在不高pH值時從水溶液中提取輻射較弱,輻射較差。
發生
所有的鐳的同位素的半衰期都比地球年齡短得多,因此任何原始的鐳很久以前都會腐爛。然而,由於同位素223 RA, 224 RA, 226 RA和228 RA是天然or和鈾同位素的衰減鏈的一部分,因此鐳仍然發生在環境中。由於Thor和鈾具有很長的半衰期,因此這些女兒不斷被腐爛而再生。在這四個同位素中,最長的壽命為226 RA(半衰期1600年),是天然鈾的衰減產物。由於其相對壽命, 226 RA是該元素最常見的同位素,構成了地殼每萬億美元的一部分。本質上,所有天然鐳均為226 RA。因此,在鈾鈾和其他各種鈾礦物質中,在礦物質礦物質中甚至較小的礦物質中發現了輻射量很小。一噸螺絲藍色通常產生約佔輻射的七分之一。地殼中的一公斤含有約900片輻射,一升海水包含約89張輻射圖。
歷史


1898年12月21日,在Jáchymov的一個鈾(Pitchblende)樣本中,瑪麗·斯克洛德斯卡·卡里(MarieSkłodowska-Curie)和她的丈夫皮埃爾·庫裡(Pierre Curie)發現了鐳。在較早研究礦物的同時,象牙從中去除了鈾,發現其餘材料仍然是放射性的。 1898年7月,在研究PitchBlende時,他們隔離了類似於Bismuth的元素,該元素原來是polonium 。然後,他們隔離了由兩個組成部分組成的放射性混合物:鋇的化合物,產生了鮮豔的綠色火焰顏色,以及未知的放射性化合物,這些化合物提供了以前從未有過記錄的胭脂紅光譜線。庫里斯發現放射性化合物與鋇化合物非常相似,除了它們不易溶解。這一發現使Curies可以隔離放射性化合物並在其中發現一個新元素。庫里斯(Curies)於1898年12月26日宣布向法國科學院的發現。射線形式的能量。
1910年9月,瑪麗·庫裡(Marie Curie)和安德烈·路易斯·黛博恩(André-Louis Debierne)宣布,他們通過使用汞陰極的純氯化物(RACL 2 )溶液將鐳作為純金分離為純屬金屬,從而產生了鐳 - 汞汞合金。然後將這種汞合金在氫氣的大氣中加熱以去除汞,從而留下純屬金屬。同年晚些時候,E。Eoler通過其疊氮化物RA(n 3 ) 2的熱分解分離了鐳。 Radium Metal是20世紀初的第一個工業生產的Biraco ,Biraco是在比利時的Olen Plant中的UnionMinièreduHaut Katanga (UMHK)的子公司公司。
放射性的一般歷史單位,居里,基於226 RA的放射性:最初定義為一克radium-226的放射性,但後來將其定義稍微精製為3.7 × 10 10每秒分解。
歷史應用
發光油漆

輻射以前用於自露的油漆,用於手錶,核面板,飛機開關,時鐘和儀表錶盤。典型的自露手錶使用賴賴塗料包含約1微克的鐳。在1920年代中期,五個垂死的“輻射女孩”(Dial“ Radium Girls”)向美國鐳公司提起了訴訟 - 在手錶和時鐘的撥盤上繪製了基於鐳的發光塗料的撥號畫家。指示錶盤畫家舔刷子以給它們一個很好的點,從而攝取鐳。它們暴露於鐳會引起嚴重的健康影響,包括瘡,貧血和骨癌。
在訴訟期間,確定公司的科學家和管理層已採取了相當大的預防措施來保護自己免受輻射的影響,但似乎並不能保護其員工。此外,幾年來,這些公司一直試圖掩蓋這種影響並避免責任,堅持認為鐳的女孩反而遭受了梅毒的痛苦。這完全無視員工福利對職業疾病勞動法的製定產生了重大影響。
訴訟的結果是,放射性的不利影響已廣為人知,並在適當的安全預防措施中指示了輻射式畫家,並提供了保護齒輪。特別是,撥號畫家不再舔油漆刷來塑造它們(這引起了輻射鹽的攝入)。直到1960年代,輻射仍被用於錶盤中,但沒有進一步的傷害來撥打畫家。這強調了對鐳女孩的傷害很容易被避免。
從1960年代開始,停用了鐳漆。在許多情況下,用光激發的非放射活性熒光材料實現了發光錶盤;暴露於光線後,這種設備在黑暗中發光,但光芒逐漸消失。如果需要在黑暗中長期持久的自luminitive,則使用更安全的放射性Promethium -147(半衰期2。6年)或Tritium (半壽命12年)的油漆;截至2004年,兩者都繼續使用。與鐳不同,這些額外的優點是不會隨著時間的推移降解磷。 Tritium排放出非常低的能量β輻射(甚至比Promethium發出的β輻射低的能源),該輻射無法穿透皮膚,而不是穿透輻射的輻射輻射,並且被認為是更安全的。
鐘錶,手錶和樂器的歷史可以追溯到20世紀上半葉,通常是在軍事應用中,可能是用放射性發光的油漆塗上的。它們通常不再發光;然而,這不是由於賴賴的放射性衰減(半衰期為1600年),而是由於輻射從輻射中磨損的鋅硫化物熒光介質的熒光。從此期間開始,在設備中,在設備中通常厚厚的綠色或黃棕色油漆的外觀表明了放射性危害。完整裝置的輻射劑量相對較低,通常不是急性風險。但是如果釋放,吸入或攝入,油漆是危險的。
商業用途
由於其所謂的治愈能力,鐳曾經是牙膏,奶霜甚至食品等產品的添加劑。此類產品很快就脫離了時尚,在發現它們可能對健康產生嚴重的不利影響之後,在許多國家的當局禁止。 (例如,請參閱“輻射水”或“飲用標準輻射液”的輻射或重演者類型。)富含鐳的水的水療中心仍然偶爾被吹捧為有益的,例如在日本托托里的Misasa中的水療中心。在美國,還對兒童進行了鼻腔輻射,以防止1940年代末期至1970年代初期的中耳問題或扁桃體增大。
醫療用途

鐳(通常是以氯化物或溴化賴氨酸的形式)用於醫學中,以產生ra射氣體,而輻射又被用作癌症治療。例如,其中幾種ra源在1920年代和1930年代在加拿大使用。但是,由於造成了有害的溴化物暴露,因此不再使用1900年代初期使用的許多治療方法。這些作用的一些例子是貧血,癌症和基因突變。截至2011年,諸如60 CO之類的更安全的伽瑪發射器(較低的成本較低且量較大)通常用於替代此應用程序中鐳的歷史使用。
在1900年代初,生物學家使用鐳誘導突變和研究遺傳學。早在1904年,丹尼爾·麥克杜格爾(Daniel MacDougal)就使用鐳以確定它是否會引起突然突然突變並引起重大進化轉移。托馬斯·亨特·摩根(Thomas Hunt Morgan)使用鐳誘導變化,導致白眼果蠅。獲獎的生物學家赫爾曼·穆勒(Hermann Muller)在轉向更負擔得起的X射線實驗之前,簡要研究了鐳對果蠅突變的影響。
約翰·霍普金斯醫院的創始醫生之一霍華德·阿特伍德·凱利(Howard Atwood Kelly)是醫療治療癌症醫療用途的主要先驅。他的第一位病人是1904年的姑姑,他在手術後不久去世。眾所周知,凱利(Kelly)使用過多的鐳治療各種癌症和腫瘤。結果,他的一些患者死於鐳暴露。他的輻射量方法是在受影響區域附近插入一個鐳囊,然後將鐳“點”直接縫到腫瘤。這是治療宮頸癌原始HeLa細胞宿主Henrietta缺乏的方法。截至2015年,使用更安全,更可用的放射性同位素。
生產

鈾在19世紀後期沒有大規模應用,因此沒有大型鈾礦。最初,鈾礦石的唯一大資源是奧地利- 匈牙利(現為捷克共和國)的賈奇摩夫的銀礦。鈾礦石只是採礦活動的副產品。
在第一次提取陽台時,居里使用了從瀝青藍色提取鈾後的殘留物。鈾是通過在硫酸中溶解的硫酸溶解而提取的,硫酸鐳類似於硫酸鋇,但在殘基中的溶解度更低。殘基還包含大量硫酸鋇,因此充當硫酸賴賴賴斯的載體。鐳提取過程的第一步涉及用氫氧化鈉沸騰,然後進行鹽酸處理,以最大程度地減少其他化合物的雜質。然後將剩餘的殘留物用碳酸鈉處理,將硫酸鋇轉化為碳酸鋇(攜帶輻射),從而使其可溶於鹽酸。溶解後,將鋇和鐳作為硫酸鹽重新沉澱。然後重複這一點以進一步純化混合硫酸鹽。通過用硫化氫處理氯化物溶液,然後進行過濾,從而去除形成不溶性硫化物的一些雜質。當混合硫酸鹽足夠純淨時,它們再次轉化為混合氯化物。此後通過分數結晶分離鋇和鐳,同時使用光譜儀監測進度(輻射給出了與綠鋇線相比具有特徵性的紅線)和電鏡。
在Jáchymov從鈾礦石中瑪麗和皮埃爾·庫裡(Pierre Curie)分離陽台後,幾位科學家開始少量分離鐳。後來,小公司從Jáchymov礦山購買了礦山尾礦,並開始隔離陽台。 1904年,奧地利政府將礦山國有化,並停止出口原礦石。直到1912年賴賴賴斯的產生增加,鐳的可用性較低。
奧地利壟斷的形成和其他國家的強烈渴望獲得鐳的渴望導致全球尋找鈾礦石。美國在1910年代初接任了主要生產商。科羅拉多州的卡諾石沙子提供了一些元素,但是在剛果和大熊湖和加拿大西北部的大從湖區的地區發現了更豐富的礦石。這兩個沉積物都沒有開採用於鐳,但鈾含量使採礦盈利。
1940年,Curies的工藝仍用於工業鐳的提取,但隨後將混合的溴化物用於分餾。如果鈾礦石的鋇含量不夠高,則很容易添加一些以攜帶鐳。這些過程應用於高級鈾礦石,但與低級礦石可能無法很好地工作。
直到1990年代,這種混合降水和離子交換方法仍然從鈾礦中提取了少量鐳,但截至2011年,它們僅從耗盡的核燃料中提取。在1954年,全球純淨的輻射總供應約為5磅(2.3千克),在2015年仍處於此範圍內,而純陽離子化合物的年生產總計僅為100 g。截至1984年。產生鐳的國家是比利時,加拿大,捷克共和國,斯洛伐克,英國和俄羅斯。產生的鐳量是而且總是相對較小。例如,在1918年,在美國產生了13.6克鐳。金屬通過在1,200°C的真空中用鋁金屬還原氧化物來分離。
現代應用

鐳在原子,分子和光學物理領域的使用越來越多。對稱性斷裂力比例比例成比例,使陽台是最重的鹼地球元素,非常適合限制超出標準模型的新物理。與199hg相比,一些輻射的同位素(例如鐳225)具有八桿動均方平均雙重雙重倍數,可以增強對均等均能違反新物理學的敏感性,從而使新物理違反兩到三個數量級。
鐳也是被困離子光學時鐘的有前途的候選者。鐳離子從基態有兩個Subhertz-line寬度過渡,可以用作光學時鐘的時鐘過渡。在過渡上已經證明了一個226RA+被困的離子原子鐘。此外,鐳特別適合於可運輸的光學時鐘,因為可以使用常見波長的直接二極管激光器來解決時鐘操作所需的所有過渡。
儘管鐳沒有穩定的同位素,但有11個鐳同位素半衰期超過一分鐘,可以將其與國王情節上的高精度進行比較。同位素偏移可以在從基態的賴氏離子subhertz-line寬轉換上,或在中性鐳中的介發生線上以高精度測量。在這樣的國王情節中,任何潛在的非線性的程度都可以在標準模型以外的新物理學上設定界限。
鐳的少數實際用途中的某些是從其放射性特性中得出的。最近發現的放射性同位素(例如鈷-60和Caesium-137 )正在替代這些有限用途的鐳,因為這些同位素中有幾種具有更強大的發射器,可以更安全地處理,並且以更加濃縮的形式使用。
2013年,美國食品藥品監督管理局批准了同位素223 RA(氯化物的商品名稱Xofigo ),以作為醫學用作骨轉移的癌症治療。用Xofigo治療的主要指示是由於這種α-發射體放射性藥物的有利特徵,從castration抗性前列腺癌中對骨轉移進行了治療。 225 RA也用於用於治療輻射的實驗中,因為它是唯一合理的長壽命鐳同位素,沒有ra是其女兒之一。
輻射在2007年仍用作某些工業X射線照相設備中的輻射源,以檢查有缺陷的金屬零件,類似於X射線成像。當與鈹混合時,鐳充當中子源。截至2004年,有時仍然使用鐳中性來源,但其他材料(例如polonium )更常見:大約1,500個polonium-beryllium中子中子源,單個活性每年在俄羅斯每年使用1,850 CI(68 tbq) 。儘管它們發出的中子數量很高(每秒1.84×10 6個中子),但這些基於RABEF 4的中子源已被貶低,但有利於241 AM - BE BE BE。截至2011年,同位素226 RA主要用於通過核反應堆中的中子照射形成227 AC 。
危險
鐳是高放射性的,其直系女兒ra rave也是放射性的。當攝入時,攝入的鐳中有80%通過糞便使人體離開,而其他20%進入血液,主要是在骨骼中積聚。這是因為人體將鐳視為鈣,並將其沉積在骨骼中,放射性降解骨髓並可以突變骨細胞。暴露於內部或外部,可能會導致癌症和其他疾病,因為輻射和ra散發出α和伽馬射線會在其衰減時殺死和突變細胞。在1944年曼哈頓項目時,工人的“公差劑量”設置為0.1微克攝入的鐳。
鐳的某些生物學作用包括1900年元素發現兩年後的1900年報導的第一種“嗎?法國物理學家安托萬·貝克雷爾(Antoine Becquerel)在他的背心口袋裡攜帶了一小段輻射的輻射,並報告說他的皮膚變得潰瘍。皮埃爾(Pierre)和瑪麗·居里(Marie Curie)對輻射非常感興趣,以至於他們犧牲了自己的健康,以進一步了解它。皮埃爾·庫裡(Pierre Curie)連接了一個裝有輻射的管子在他的手臂上持續了十個小時,從而導致皮膚病變的出現,這表明在攻擊健康組織時使用鐳攻擊癌組織。由於性貧血而導致的瑪麗·庫裡(Marie Curie)死亡,因此對鐳的處理被指責。大量鐳的危險來自其女兒ra:作為一種氣體,它可以比其母輻射更容易進入人體。
截至2015年, 226 RA被認為是該數量無線電元素中最具毒性的,並且必須在帶有大量氣流循環的緊身手套箱中處理,然後對其進行處理,以避免將其女兒222 RN逃到環境中。必須謹慎地打開含有輻射溶液的舊安木木,因為水的放射性分解可以產生氫氣和氧氣的過壓。世界上最大的226 RA濃度存儲在紐約尼亞加拉瀑布以北約9.6英里(15.4公里)的臨時廢物遏制結構中。輻射的最大污染物水平(MCL)的飲用水為5pci/L,但是,由於已經設置了輻射極限,因此OSHA未設置暴露限制。
